Какой объем серной кислоты (H2SO4) с массовой долей кислоты 10% (плотность раствора равна 1,07 г/см3) потребуется для нейтрализации раствора, содержащего 16 грамм гидроксида натрия (NaOH).
Решение задачи
Запишем реакцию нейтрализации раствора гидроксида натрия (NaOH) с раствором серной кислоты (H2SO4) с массовой долей кислоты 10%:
![]()
Учитывая, что молярные массы гидроксида натрия (NaOH) и серной кислоты (H2SO4) соответственно равны 40 г/моль и 98 г/моль, по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 16 г гидроксида натрия (NaOH):
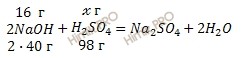
на нейтрализацию 80 г NaOH нужно 98 г H2SO4
на нейтрализацию 16 г NaOH нужно ![]() г H2SO4
г H2SO4
Откуда:
![]()
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора:
![]()
Получаем:
m (раствора H2SO4) = 19,6 / 0,1 = 196 (г).
Если раствор 10-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,1.
Рассчитаем объем раствора серной кислоты (H2SO4) с массовой долей кислоты 10% по формуле, устанавливающей связь между объемом и массой:
![]()
Получаем:
V (раствора H2SO4) = 196 / 1,07 = 183,18 (см3).
Ответ:
объем серной кислоты равен 183,18 см3.

БОЛЬШОЕ СПАСИБО ВЫРУЧЕЛИ КАК НЕ КОГДА!!!!!
Рада помочь!