При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
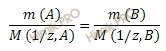
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
Получаем:
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
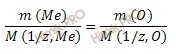
Из уравнения находим молярную массу эквивалента металла:
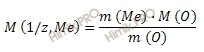 Получаем:
Получаем:
![]()
Рассчитаем молярную массу металла по формуле:
![]()
Где:
М – молярная масса,
В – валентность,
Э – эквивалентная масса
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
![]()
Получаем:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
