Найдите степень гидролиза 0,001 нормального ацетата калия (CH3COOK) и pH этого раствора. K (CH3COOH) = 1,75 ⋅ 10-5.
Решение задачи
Степень и константа гидролиза связаны соотношением:
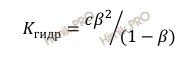
Где:
с – концентрация соли, моль/л;
β – степень гидролиза соли;
Kгидр– константа гидролиза.
Обычно степень гидролиза соли β значительно меньше единицы, поэтому приведенное выше выражение можно упростить:
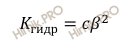
Соль ацетат калия (CH3COOK) образована слабой кислотой (уксусной кислоты – CH3COOH) и сильным основанием (гидроксидом калия – KOH).
Для расчета константы гидролиза (Кгидр) соли сильного основания и слабой кислоты вычисляют по формуле:
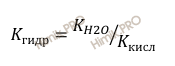
Где:
Ккисл – константа диссоциации слабой кислоты.
Если константу гидролиза выразить через данное отношение, получим выражение:
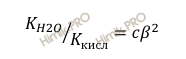
Отсюда:
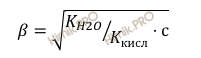
Степень гидролиза 0,001 нормального ацетата калия (CH3COOK) равна:
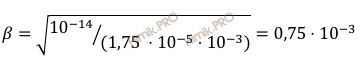
Запишем уравнение гидролиза ацетата калия (CH3COOK):
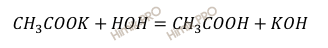
Применив закон действующих масс к этой реакции, получим:
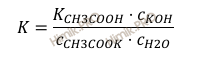
Значение с (H2O) в разбавленных растворах можно считать постоянным. Обозначив произведение K ⋅ c (H2O) через Кгидр, имеем:
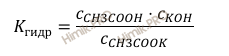
Концентрация образовавшейся при гидролизе уксусной кислоты (CH3COOH) равна концентрации ионов OH—, тогда:
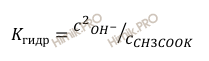
Используя это выражение, можно определить pH раствора:
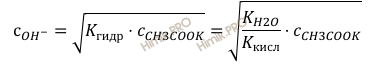
Получаем:
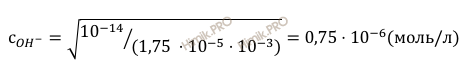
сH+ = 10-14 /0,75 ⋅ 10-6 = 1,32 ⋅ 10-8 (моль/л);
Вычислим водородный показатель по формуле:
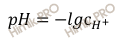
Получаем:
pH = — lg 1,32 ⋅ 10-8 = 7,9.
Ответ:
степень гидролиза 0,75 ⋅ 10-3;
pH 7,9.
