Рассчитайте объем сернистого газа (SO2), который выделяется при взаимодействии меди (Cu) массой 12,8 грамм с избытком концентрированной серной кислоты (H2SO4).
Решение задачи
Составим уравнения реакции взаимодействия меди с концентрированной серной кислоты (H2SO4):
![]()
Найдем химическое количество меди по формуле, устанавливающей связь между химическим количеством вещества и массой:
![]()
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль получаем:
n (Cu) = 12,8/63,5 = 0,2 (моль).
По уравнению реакции рассчитаем, сколько моль сернистого газа (SO2) образуется в ходе реакции:
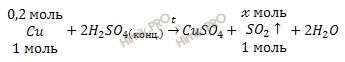
при участии 0,2 моль Cu образуется ![]() моль SO2
моль SO2
при участии 1 моль Cu образуется 1 моль SO2
Откуда:
![]()
Найдем сколько литров сернистого газа (SO2) образуется при взаимодействии меди (Cu) с избытком концентрированной серной кислоты (H2SO4) по формуле, устанавливающей связь между объемом и химическим количеством вещества:
![]()
Получаем:
V (SO2) = 0,2 ∙ 22,4 = 4,48 (л).
Ответ:
объем сернистого газа равен 4,48 литра.
