Найти массу осадка сульфата бария (BaSO4), который образуется при взаимодействии 15 грамм 5% раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4).
Решение задачи
Запишем уравнение реакции образования осадка сульфата бария (BaSO4) при взаимодействии раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4):
![]()
Зная массу и массовую долю раствора хлорида бария (BaCl2), для решения задачи будем использовать формулу нахождения массовой доли растворенного вещества:
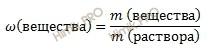
Выразим из формулы массу вещества:
![]()
Найдем массу хлорида бария (BaCl2), который необходим для образования осадка сульфата бария:
m (BaCl2) = 15 ⋅ 0,05 = 0,075 (г).
Если раствор 5-процентный, то массовая доля соли в нем 0,05.
Рассчитаем молярные массы хлорида бария (BaCl2) и сульфата бария (BaSO4), используя данные таблицы Менделеева:
M (BaCl2) = 137 + 2 ⋅ 35,5 = 208 (г/моль),
M (BaSO4) = 137 + 32 + 4 ⋅ 16 = 233 (г/моль).
Из уравнения реакции взаимодействия раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4) найдем массу осадка сульфата бария:
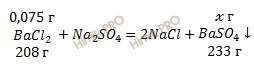
0,075 г BaCl2 участвует в образавании х г осадка сульфата бария
208 г BaCl2 участвует в образавании 233 г осадка сульфата бария
Откуда:
![]()
Ответ:
масса осадка сульфата бария равна 0,084 грамма.
