Сколько миллилитров раствора с массовой долей хлорида бария (BaCl2) 4% и плотностью 1,02 г/см3 следует прибавить к раствору серной кислоты (H2SO4) для образования 11,65 грамм сульфата бария (BaSO4)? Хлорид бария серная кислота
Решение задачи
Составим уравнение реакции взаимодействия хлорид бария серная кислота:
![]()
Учитывая, что молярные массы сульфата бария (BaSO4) и хлорида бария (BaCl2) соответственно равны 233 г/моль, 208 г/моль (смотри таблицу Менделеева), по уравнению реакции хлорид бария серная кислота рассчитаем, сколько грамм хлорида бария (BaCl2) следует прибавить к раствору серной кислоты (H2SO4) для образования сульфата бария (BaSO4):
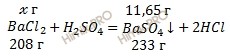
х г хлорида бария участвует в образовании 11,65 г сульфата бария
208 г хлорида бария участвует в образовании 233 г сульфата бария
Откуда:
![]()
Хлорид бария серная кислота. Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора:
![]()
Получаем, что масса раствора хлорида бария (BaCl2) равна:
m (BaCl2) = 10,4 / 0,04 = 260 (г).
Если раствор хлорида бария 4%, то массовая доля соли в нем 0,04.
Хлорид бария серная кислота. Вычислим объем раствора хлорида бария (BaCl2) используя формулу, устанавливающую связь между объемом и массой раствора:
![]()
Получаем:
V (BaCl2) = 260/1,02 = 254,9 (мл).
Ответ:
объем раствора хлорида бария 254,9 миллилитров.
