Рассчитайте массу воды (H2О), в которой надо растворить 100 грамм кристаллической соды (Na2CO3 ∙ 10 H2O) для получения 10-процентного раствора карбоната натрия (Na2CO3).
Решение задачи
Рассчитаем молярные массы карбоната натрия (Na2CO3) и кристаллической соды (Na2CO3 ∙ 10 H2O):
M (Na2CO3) = 106 (г/моль),
M (Na2CO3 ∙ 10 H2O) = 106+ 10 ∙ 18 = 286 (г/моль).
Учитывая, что в 1 моль кристаллической соды (Na2CO3 ∙ 10 H2O) содержится 1 моль карбоната натрия (Na2CO3), найдем массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (Na2CO3) = 1 моль ∙ 106 г/моль = 106 (г)
m (Na2CO3 ∙ 10 H2O) = 1 моль ∙ 286 г/моль = 286 (г).
Вычислим, какое количество карбоната натрия (Na2CO3) (в г) содержится в 100 г кристаллогидрата (кристаллической соды (Na2CO3 ∙ 10 H2O)). Составим пропорцию:
в 286 г Na2CO3 ∙ 10 H2O содержится 106 г Na2CO3
в 100 г Na2CO3 ∙ 10 H2O содержится ![]() г Na2CO3
г Na2CO3
Откуда:
![]()
Массу кристаллизационной воды можно вычислить по формуле:
![]()
Получаем:
m (крист. воды) = 100 – 37,06 = 62,94 (г).

Используя формулу нахождения массовой доли вещества:
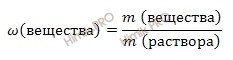 найдем массу 10-процентного раствора карбоната натрия (Na2CO3) по формуле:
найдем массу 10-процентного раствора карбоната натрия (Na2CO3) по формуле:
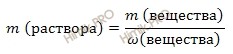 Получаем:
Получаем:
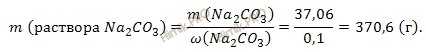
Если раствор 10-процентный, то массовая доля карбоната натрия (Na2CO3) в нем 0,1.
Вычислим массу воды (H2O) в 10-процентном растворе по формуле:
![]() Получаем:
Получаем:
m (H2O) = 370,6 – 37,06 = 333,54 (г).
Найдем массу воды (H2O), которую необходимо взять для приготовления раствора:
m (H2O для растворения кристаллогидрата) = m (H2O в растворе) — m (кристаллизационной H2O)
m (H2O) = 333,54 – 62,94 = 270,6 (г).
Ответ: масса воды равна 270,6 грамм.
