Растворимость безводного сульфата цинка (ZnSO4) при температуре 30 0С равна 322 г/л. Какой минимальный объем воды (в л), необходимый для растворения при этой температуре 143,5 г ZnSO4 ∙ 7H2O?
Решение задачи
Найдем, сколько безводного сульфата цинка и воды содержится в 143,5 г кристаллогидрата. Для этого рассчитаем молярные массы сульфата цинка (ZnSO4) и кристаллогидрата(ZnSO4 ∙7H2O):
M (ZnSO4) = 161 (г/моль).
M (ZnSO4 ∙ 7H2O) = 161 + 7 18 = 287 (г/моль).
Учитывая, что молярные массы кристаллогидрата(ZnSO4 ∙ 7H2O) и безводного сульфата цинка(ZnSO4) соответственно равны 287 и 161 г/моль, составим пропорцию:
в 287 г ZnSO4 ∙7H2O содержится 161 г ZnSO4
в 143,5 г ZnSO4 ∙7H2O содержится ![]() г ZnSO4
г ZnSO4
Откуда:
![]()
Масса воды, содержащейся в кристаллогидрате, равна:
![]()
Принимая плотность воды равной 1 г/см3, найдем, что объем 63 г воды (H2O) равен 0,063 л 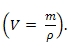
Зная растворимость сульфата цинка, вычислим, сколько воды потребуется для растворения 80,5 г ZnSO4. Составим пропорцию:
322 г ZnSO4 растворяется в 1 л H2O
80,5 г ZnSO4 растворяется в л H2O
Откуда:
![]()
Вычислим объем воды, который необходимо взять для растворения соли:
0,25 л – 0,063 л = 0,187 (л).
Ответ: объем воды = 0,187 л.

Очень хороший сайт и решение тоже самое лучшее.Спасибо большое!!!
Спасибо за приятный отзыв! Стараюсь!