Из 10 килограммов раствора с массовой долей хлорида натрия (NaCl) 20 % при охлаждении выделилось 400 грамм соли. Чему равна массовая доля соли хлорида натрия (NaCl) в охлажденном растворе?
Решение задачи
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, а полученный как 2 раствор.
Введем обозначения:
ω1, ω2 – массовая доля соли (растворенного вещества) соответственно в 1 растворе, во 2 растворе;
m1 (вещества), m2 (вещества) – массы растворенных веществ в соответствующих растворах;
m1 (раствора), m2 (раствора) – массы соответствующих растворов.
Используя формулу нахождения массовой доли соли (вещества) в растворе:
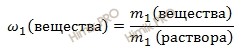
выразим массу первого вещества:
![]()
Получаем:
m1 (вещества) = 10000 ⋅ 0,2 = 2000 (г).
NB! Если раствор 20-процентный, то массовая доля соли в нем 0,2.
По условию задачи при охлаждении раствора хлорида натрия (NaCl) выделилось 400 г соли, следовательно масса растворенного вещества в полученном растворе равна:
m2 (вещества) = 2000 – 400 = 1600 (г).
Найдем массу 2 раствора:
m2 (раствора) = 10000 – 400 = 9 600 (г).
Запишем общую формулу для нахождения массовой доли соли в полученном растворе:
![]()
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Получаем:
ω2 (вещества) = 1600 / 9600 = 0,167 или 16,7 %
Ответ:
массовая доля хлорида натрия в охлажденном растворе равна 16,7 %.
