Определите константу равновесия химической реакции, если при некоторой температуре равновесные концентрации составляют: [NOCl2] = 0,05 M, [NO]= 0,55 M, [NOCl] = 0,08 M.
NOCl2(г) + NO(г) = 2NOCl(г)
Решение задачи
Рассмотрим обратимую химическую реакцию:
![]()
Напомню, константа равновесия химической реакции (обратимой химической реакции) равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции.
В данной задаче константа равновесия химической реакции выражается уравнением:
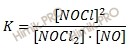
Для одной и той же температуры отношение произведений равновесных концентраций (в степенях их стехиометрических коэффициентов) веществ в правой и левой частях уравнения химической реакции представляет постоянную величину.
Поэтому получаем, константа равновесия химической реакции:
K = (0,08)2 /0,05 ⋅ 0,55 = 0,233
Ответ:
константа равновесия химической реакции 0,233.
