Объемный состав реакционной смеси в момент равновесия для реакции 2CO2 = 2CO + O2 был следующий: 88,7 % CO2, 7,52 % CO, 3,76 % O2. Найдите Kp и Kc для этой реакции, если общее давление в системе при данной температуре (273 К) равно 1,0133 ⋅ 105 Па.
Решение задачи
Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. Константу равновесия Kp вычисляют через парциальные давления:
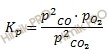
Где:
Kp – константа химического равновесия;
р (CO), р (O2), р (CO2)– парциальные давления соответственно CO, O2, CO2, Па.
Состав реакционной смеси. Определяем парциальные давления реагирующих веществ:
р (CO2) = 1,0133 ⋅ 105 ⋅ 0,8872 = 0,899 ⋅ 105 (Па);
р (CO) = 1,0133 ⋅ 105 ⋅ 0,0752 = 0,0762 ⋅ 105 (Па);
р (CO2) = 1,0133 ⋅ 105 ⋅ 0,0376 = 0,0381 ⋅ 105 (Па).
Получаем:
Kp = (0,0762 ⋅ 105)2 ⋅ 0,0381 ⋅ 105 /(0,899⋅ 105)2 = 27,35 (Па).
Состав реакционной смеси.
На основании уравнения состояния идеального газа Менделеева – Клайперона:
![]()
Где:
Δn – разность между числом молей газообразных веществ после и до реакции:
![]()
Δn = 3 – 2 = 1;
R = 8,3144 Дж/(моль ⋅ K);
T = 273 К.
Получаем:
Kc = 27,35 /8,3144 ⋅ 2273 = 1,44 ⋅ 10-3.
Ответ:
Kp равна 27,35 Па;
Kc равна 1,44 ⋅ 10-3.
