При взаимодействии 0,1 нормального раствора тиосульфата натрия (Na2S2O3) с избытком серной кислоты (H2SO4) получено 4,8 грамм серы (S). Какой объем раствора тиосульфата натрия (Na2S2O3) вступил в реакцию?
Решение задачи
Запишем уравнения реакции получения серы:
![]()
![]()
При взаимодействии тиосульфата натрия (Na2S2O3) с серной кислотой (H2SO4), получается тиосульфат водорода (H2S2O3) (или тиосерная кислота), который разлагается с образованием сернистой кислоты (H2SO3) и серы (S).
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
![]()
Рассчитаем молярную массу тиосульфата натрия (Na2S2O3):
M (Na2S2O3) = 2 ∙23 + 2 ∙ 32 + 3 ∙ 16 = 158 (г/моль).

Учитывая, что молярная масса серы (S) равна 32 г/моль, по уравнению реакции рассчитаем, какая масса раствора тиосульфата натрия (Na2S2O3) вступила в реакцию:
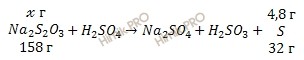
![]() г тиосульфата натрия участвует в получении 4,8 г S
г тиосульфата натрия участвует в получении 4,8 г S
158 г тиосульфата натрия участвует в получении 32 г S
Откуда:
![]()
Рассчитаем молярную массу эквивалента тиосульфата натрия (Na2S2O3) по формуле:
![]()
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Учитывая, что атомы тиосульфата натрия (Na2S2O3) вступают в реакцию диспропорционирования:
![]()
![]()
из уравнений полуреакций видно, что в окислительно восстановительной реакции принимает участие 4 e—, следовательно, fэкв = 1/4.
Рассчитаем молярную массу эквивалента тиосульфата натрия (Na2S2O3):
MЭ (Na2S2O3) = 158 ∙ 1/4 = 39,5 (г/моль).
Из формулы нахождения нормальной концентрации раствора, выразим объем:
![]()
Получаем:
V (Na2S2O3) = 23,7 / 39,5 ∙ 0,1 = 6 (л).
Ответ:
объем раствора тиосульфата натрия (Na2S2O3) равен 6 литров.
