Определите нормальную концентрацию (молярная концентрация эквивалента) раствора соляной кислоты (HCl), если на нейтрализацию 250 миллилитров ее потребовалось 100 миллилитров 0,15 н раствора гидроксида натрия (NaOH).
Решение задачи
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N»
![]() По условию задачи протекает реакция нейтрализации соляной кислоты (HCl) раствором гидроксида натрия (NaOH):
По условию задачи протекает реакция нейтрализации соляной кислоты (HCl) раствором гидроксида натрия (NaOH):
![]()
Существует правило: растворы разной нормальности реагируют между собой в объемах обратно пропорциональных их нормальностям:
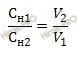 Введем обозначения:
Введем обозначения:
CH1 – нормальная концентрация раствора соляной кислоты (HCl);
V1 – объем раствора соляной кислоты (HCl);
CH2 – нормальная концентрация раствора гидроксида натрия (NaOH);
V2 – объем раствора гидроксида натрия (NaOH).
Запишем формулу расчета нормальной концентрации раствора соляной кислоты (HCl):
![]()
Таким образом, получаем:
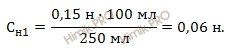
Ответ: нормальная концентрация раствора соляной кислоты равна 0,06 н.
