Сколько 9-процентного раствора карбоната калия (K2CO3) и 12-процентного раствора хлорида кальция (CaCl2) (в граммах) потребуется для получения 30 грамм карбоната кальция (CaCO3)?
Решение задачи
Запишем уравнение реакции образования карбоната кальция (CaCO3) при смешении раствора карбоната калия (K2CO3) и раствора хлорида кальция (CaCl2):
![]()
Учитывая, что молярные массы карбоната калия (K2CO3), хлорида кальция (CaCl2) и карбоната кальция (CaCO3) соответственно равны 138, 111 и 100 г/моль (смотри таблицу Менделеева), вычислим массы данных веществ по формуле, учитывая количество моль из уравнения реакции:
![]()
Получаем:
m (K2CO3) = 1 моль ∙ 138 г/моль = 138 (г),
m (CaCl2) = 1 моль ∙ 111 г/моль = 111 (г),
m (CaCO3) = 1 моль ∙ 100 г/моль = 100 (г).
Вычислим, сколько карбоната калия (K2CO3) и хлорида кальция (CaCl2) (в граммах) необходимо взять для получения 30 г карбоната кальция (CaCO3):
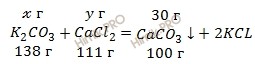
для получения 100 г карбоната кальция потребуется 138 г карбоната калия
для получения 30 г карбоната кальция потребуется х г карбоната калия
Откуда:
![]()
для получения 100 г карбоната кальция потребуется 111 г хлорида кальция
для получения 30 г карбоната кальция потребуется y г хлорида кальция
Откуда:
![]()
Найдем массу 9-процентного раствора карбоната калия (K2CO3), содержащего 41,4 г карбоната калия (K2CO3) по формуле:
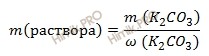
m (раствора) = 41,4 / 0,09 = 460 (г).
Если раствор карбоната калия 9-процентный, то массовая доля карбоната калия (K2CO3) в нем 0,09.
Найдем массу 12-процентного раствора хлорида кальция (CaCl2), содержащего 33,3 г хлорида кальция (CaCl2) по формуле:
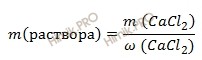
m (раствора) = 33,3 / 0,12 = 277,5 (г).
Если раствор хлорида кальция 12-процентный, то массовая доля хлорида кальция (CaCl2)в нем 0,12.
Ответ:
масса раствора карбоната калия равна 460 грамм;
масса раствора хлорида кальция равна 277,5 грамм.
