Сколько 11,2-процентного раствора гидроксида калия (KOH) (в граммах) потребуется для нейтрализации 300 грамм 19,6-процентного раствора серной кислоты (H2SO4)?
Решение задачи
Напомню, что под реакцией нейтрализации (от лат. neuter – ни тот, ни другой) понимают взаимодействие кислот с основаниями, в результате которого образуются соли и вода.
Запишем уравнение реакции нейтрализации:
![]()
Найдем, сколько серной кислоты (H2SO4) (в г) содержится в 300 г 19,6-процентного раствора по формуле нахождения массы вещества:
![]() Откуда:
Откуда:
m (H2SO4) = 300 ∙ 0,196 = 58,8 (г).
Если раствор 19,6-процентный, то массовая доля в нем 0,196.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 и 98 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Учитывая количество моль из уравнения реакции, получаем:
m (KOH) = 2 моль ∙ 56 г/моль = 112 (г)
m (H2SO4) = 1 моль ∙ 98 г/моль = 98 (г).
По уравнению реакции найдем, сколько гидроксида калия (KOH) (в г) потребуется для нейтрализации 58,8 г серной кислоты (H2SO4):
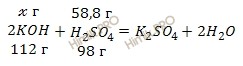
98 г H2SO4 взаимодействуют со 112 г KOH
58,8 г H2SO4 взаимодействуют с ![]() г KOH
г KOH
Откуда:
![]()
Найдем массу 11,2-процентного раствора, содержащего 67,2 г гидроксида калия (KOH). Составим пропорцию:
в 100 г раствора содержится 11,2 г KOH
в![]() г раствора содержится 67,2 г KOH
г раствора содержится 67,2 г KOH
Откуда:
![]()
Ответ: масса раствора гидроксида калия равна 600 г.

все супер! Спасибо ВАМ огромнейшее за помощь!!!!
Пожалуйста!