Какова масса воды, присоединяющейся к 33,3 граммам безводного хлорида кальция при образовании его гексагидрата CaCl2 ∙ 6H2O.
Решение задачи
Рассчитаем молярные массы хлорида кальция (CaCl2), воды (H2O) и гексагидрата (CaCl2 ∙ 6H2O):
M (CaCl2) = 111 (г/моль).
M (H2O) = 18 (г/моль).
M (CaCl2 ∙ 6H2O) = 111 + 6 ∙ 18 = 219 (г/моль).
Учитывая, что в 1 моль кристаллогидрата (CaCl2 ∙ 6H2O) содержится 1 моль безводного хлорида кальция (CaCl2) и 6 моль воды (H2O), найдем массы данных веществ по формуле, устанавливающей связь между массой и количеством вещества:
![]() Получаем:
Получаем:
m (CaCl2) = 1 моль ∙ 111 г/моль = 111 (г).
m (H2O) = 6 моль ∙ 18 г/моль = 108 (г).
m (CaCl2 ∙ 6H2O) = 1 моль ∙ 219 г/моль = 219 (г).
Учитывая, что 1 моль безводного хлорида кальция (CaCl2) может присоединять 6 моль воды (H2O), вычислим массу присоединяемой воды. Составим пропорцию:
111 г CaCl2 присоединяет 108 г H2O
33,3 г CaCl2 присоединяет ![]() г H2O
г H2O
Откуда:
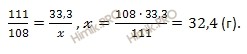
Ответ: масса воды = 32,4 грамма.
