При растворении в кислоте металла массой 11,9 грамм выделился водород объемом 2,24 литра (нормальные условия). Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Решение
Согласно закону эквивалентов: массы (объемы)реагирующих веществ пропорциональны молярным массам (объемам) эквивалента этих веществ.
Учитывая, что эквивалентный объем водорода (H) равна 11,2 л, определим эквивалентную массу металла по закону эквивалентов:
![]()
Откуда выразим эквивалентную массу металла:
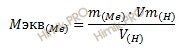
Получаем:
M экв (Me) = 11,9 ∙ 11,2 / 2,24 = 59,5 (г/моль).
Молярная масса эквивалента – равна произведению фактора эквивалентности на молярную массу вещества.
![]()
Если валентность металла z (Ме) = 1, то М = Мэ = 59,5 г/моль — одновалентного металла с такой молярной массой нет (смотри таблицу Менделеева).
Если z(Ме) = 2, то М = 2Мэ = 119 г/моль – двухвалентного металла с такой молярной массой нет.
Если z(Ме) = 3, то М = 3Мэ = 178,5 г/моль – гафний.
Фактор эквивалентности металла 1/3.
Ответ:
эквивалентная масса металла 59,5 г/моль;
фактор эквивалентности металла 1/3.
