При взаимодействии магния (Mg) массой 1,2 грамма с раствором серной кислоты (H2SO4) получим соль массой 4,5 грамм. Определите выход продукта реакции в %.
Решение задачи
Запишем уравнение реакции взаимодействия магния (Mg) с раствором серной кислоты (H2SO4 ):
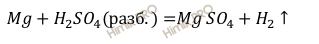
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
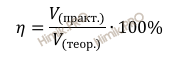
Учитывая, что молярная масса магния (Mg) и сульфата магния (MgSO4) соответственно равна 24 г/моль и 120 г/моль (смотри таблицу Менделеева), по уравнению реакции взаимодействия магния с раствором серной кислоты найдем массу сульфата магния (MgSO4)(теоретическая масса), которая образуется в ходе реакции:
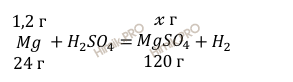
1,2 г Mg участвует в образовании х г MgSO4
24 г Mg участвует в образовании 120 г MgSO4
Откуда:
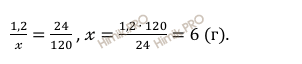
Итак, по условию задачи практический выход реакции составляет 4,5 грамма.
Рассчитаем выход продукта реакции по формуле и получим:
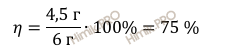
Ответ:
выход продукта реакции равен 75 %.
