К 20 граммам оксида калия (K2O) добавили раствор серной кислоты (H2SO4). Определите массу образовавшейся соли (массу сульфата калия (K2SO4)), если выход продукта составляет 80%.
Решение задачи
Запишем уравнение реакции оксида калия (K2O) с раствором серной кислоты (H2SO4):

Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
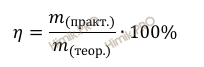
Учитывая, что молярная масса оксида калия (K2O) и молярная масса образовавшейся соли (масса сульфата калия (K2SO4)) соответственно равны 94,2 г/моль и 174,3 г/моль (смотри таблицу Менделеева), по уравнению реакции найдем массу образовавшейся соли (массу сульфата калия (K2SO4)) (теоретическая масса):
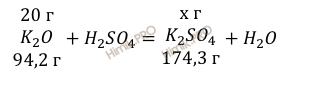
из 94,2 г K2O получается 174,3 г C6H5Cl
из 20 г K2O получается х г C6H5Cl
Откуда найдём массу сульфата калия (K2SO4):
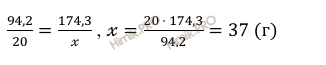
Вычислим массу образовавшейся соли (массу сульфата калия (K2SO4)) практическую по формуле:
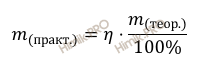
Получаем, что практическая масса сульфата калия равна:
m практ. (K2SO4) = 80 ⋅ 37 / 100 = 29,6(г).
Ответ:
масса образовавшейся соли (масса сульфата калия) равна 29,6 грамм.
