Найти массу кислорода (O2), необходимого для полного сжигания 67,2 литров (нормальные условия) сероводорода (H2S) до сернистого газа (SO2).
Решение задачи
Запишем уравнение реакции горения сероводорода (H2S):
![]()
Отмечу то, что если сжигаемое вещество содержит серу, то при горении, независимо от количества кислорода, образуется сернистый газ (SO2).
Учитывая, что сероводорода (H2S) – бесцветный газ с характерным запахом, вычислим химическое количество сероводорода (H2S) по формуле, устанавливающей связь между химическим количеством вещества и объемом:
![]()
Получаем:
n (H2S) = 67,2 / 22,4 = 3 (моль).
По уравнению реакции рассчитаем химическое количество кислорода (O2), необходимого для полного сжигания 67,2 литров сероводорода (H2S):
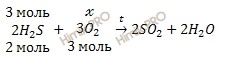
х моль O2 необходимо для полного сжигания 3 моль H2S
3 моль O2 необходимо для полного сжигания 2 моль H2S
Откуда:
![]()
Учитывая, что молярная масса кислорода (O2) равна 32 г/моль, найдем массу кислорода (O2) по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (O2) = 4,5 ∙ 32 = 144 (г).
Ответ:
масса кислорода (O2) равна 144 грамма.
