Рассчитайте объем 20-процентного раствора соляной кислоты (HCl) (плотность=1,1 г/мл), необходимого для получения 5,6 литров углекислого газа (CO2) из известняка (CaCO3) с 5-процентной примесью.
Решение задачи
Запишем уравнение реакции воздействия соляной кислоты (HCl) на известняк (CaCO3), в результате чего получается углекислый газ (CO2):
![]()
В ходе реакции образуется угольная кислота (H2CO3) – слабая кислота, которая разлагается на воду (H2O) и диоксид углерода (CO2) – углекислый газ.
Учитывая, что углекислый газ (CO2) – газ, вычислим химическое количество углекислого газа (CO2), полученного из известняка (CaCO3), по формуле, устанавливающей связь между химическим количеством вещества и объемом:
![]()
Получаем:
n (CO2) = 5,6 / 22,4 = 0,25 (моль).
По уравнению реакции рассчитаем химическое количество соляной кислоты (HCl), которая вступила в реакцию с известняком (CaCO3):
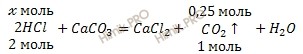
x моль HCl вступает в реакцию с 0,25 моль CO2
2 моль HCl вступает в реакцию с 1 моль CO2
Откуда:
![]()

Учитывая, что молярная масса соляной кислоты (HCl) равна 36,5 г/моль, найдем массу соляной кислоты (HCl) по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (HCl) = 0,5 ∙ 36,5 = 18,25 (г).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора:
![]()
Получаем:
m (раствора HCl) = 18,25 / 0,2 = 91,25 (г).
Если раствор 20-процентный, то массовая доля соляной кислоты (HCl) в нем 0,2.
Рассчитаем объем раствора соляной кислоты (HCl), которая вступила в реакцию с известняком (CaCO3), по формуле, устанавливающей связь между объемом и массой:
![]()
Получаем:
V (раствора HCl) = 91,25 / 1,1 = 82,95 (мл).
Ответ:
объем раствора соляной кислоты (HCl) равен 82,95 мл.
