Алюминий (Al) массой 18,0 грамм полностью растворили в 1000 грамм раствора 20-процентной соляной кислоты (HCl). Определите массовую долю соляной кислоты (HCl) в полученном растворе.
Решение задачи
Запишем уравнение реакции алюминия (Al) с соляной кислотой (HCl):
![]() Учитывая, что молярные массы алюминия (Al) и соляной кислоты (HCl) соответственно равны 27 г/моль и 36,5 г/моль, по уравнению реакции найдем, сколько соляной кислоты (HCl) (в г) пошло на растворение алюминия (Al):
Учитывая, что молярные массы алюминия (Al) и соляной кислоты (HCl) соответственно равны 27 г/моль и 36,5 г/моль, по уравнению реакции найдем, сколько соляной кислоты (HCl) (в г) пошло на растворение алюминия (Al):
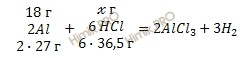
![]() г HCl растворяет 18 г Al
г HCl растворяет 18 г Al
219 г HCl растворяет 54 г Al
Откуда:
![]()
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, а полученный как 2 раствор.
Введем обозначения:
ω1, ω2 – массовая доля растворенного вещества соответственно в 1 растворе, во 2 растворе;
m1 (вещества), m2 (вещества) – массы растворенных веществ в соответствующих растворах;
m1 (раствора), m2 (раствора) – массы соответствующих растворов.
Далее, для решения задачи используем формулу нахождения массовой доли растворенного вещества:
![]() Выразим из формулы :
Выразим из формулы :
![]()
Найдем, сколько соляной кислоты (HCl) (в г) содержится в 1000 г 20-процентного раствора по формуле нахождения массы вещества:
m1 (HCl) = 1000 ∙ 0,2 = 200 (г).
Если раствор 20-процентный, то массовая доля соляной кислоты (HCl) в нем 0,2.
Итак, запишем общую формулу для нахождения массовой доли вещества в полученном растворе:
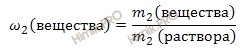
Учитывая, что после растворения алюминия масса соляной кислоты (HCl) уменьшилась на 73 г, получаем:
m2 (вещества) = 200 г – 73 г = 127 (г).
Также изменилась масса полученного раствора:
m2 (раствора) = 1000 г – 73 = 927 (г).
Используя формулу для нахождения массовой доли вещества в полученном растворе, определим массовую долю соляной кислоты (HCl):
![]()
Ответ:
массовая доля соляной кислоты в полученном растворе равна 0,137.

Пожалуйста помогите решить задачу! 500 мл 32% кислоты плотностью 1,2 грам деленой на мл.Прибавили 1л воды.Опридилите массовую долю кислоты полученой в ростворе!!!
Добрый вечер, Владимир! Решение задачи я разместила http://himik.pro/rastvory/massovaya-dolya-kislotyi
Огромное вам спасибо.
сам бы я не разобрался)
Пожалуйста, обращайся еще