Вычислите суммарное число моль ионов водорода (H+) и гидросульфит-ионов (HSO3—), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень электролитической диссоциации кислоты в растворе по первой ступени равна 40 % (электролитической диссоциацией кислоты по второй ступени пренебречь).
Решение задачи
Запишем уравнение электролитической диссоциации кислоты сернистой (H2SO3) по первой и второй ступени:
![]()
![]() Учитывая, что степень электролитической диссоциации кислоты в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
Учитывая, что степень электролитической диссоциации кислоты в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
![]()
Откуда выразим число моль электролита, распавшихся в растворе на ионы:
![]()
По уравнению электролитической диссоциации кислоты вычислим, сколько моль ионов (H+) и гидросульфит-ионов (HSO3—) образуется при диссоциации 0,04 моль сернистой кислоты (H2SO3) :
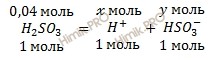
при электролитической диссоциации кислоты 1 моль образуется 1 ионов H+
при электролитической диссоциации кислоты 4 моль образуется х моль ионов H+
Откуда:
![]()
при электролитической диссоциации кислоты 1 моль образуется HSO3—ионов
при электролитической диссоциации кислоты0,04 моль образуется HSO3— ионов
Откуда:
![]()
В результате получаем, что суммарное число моль ионов водорода (H+) и сульфит-ионов (HSO3—) равно 0,08 моль (0,04 моль + 0,04 моль).
Ответ:
суммарное число моль ионов водорода и гидросульфит-ионов равно 0,08 моль.
