Смесь оксидов кальция (CaO) и магния (MgO) массой 2,08 грамм полностью растворили в азотной кислоте (HNO3) и получили 6,4 грамм смеси нитратов. Найдите массовую долю оксида магния (MgO) в смеси оксидов.
Решение задачи
Способ решения II (I способ)
Запишем уравнения реакций взаимодействия азотной кислоты (HNO3) с оксидами кальция (CaO) и магния (MgO) в смеси оксидов:
![]()
![]()
Учитывая, что молярные массы оксида кальция (CaO), оксида магния (MgO), нитрата кальция (Ca(NO3)2) и нитрата магния (Mg(NO3)2) соответственно равны 56 г/моль, 40 г/моль, 164 г/моль и 148 г/моль (смотри таблицу Менделеева), обозначим содержание оксида кальция (CaO) в смеси оксидов кальция (CaO) и магния (MgO) через х грамм, а содержание оксида магния (MgO) в смеси оксидов кальция (CaO) и магния (MgO) составит у грамм.
Обозначим массу нитрата кальция (Ca(NO3)2), образующегося в уравнении (1) a грамм; массу нитрата магния (Mg(NO3)2), образующегося в уравнении (2) b грамм:
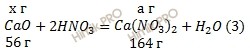
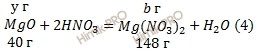 Из уравнений (3,4) смесь оксидов следует:
Из уравнений (3,4) смесь оксидов следует:
х + у = 2,08
а + b = 6,4 (г).
Из уравнения (1):
а = 164 ⋅ х / 56 = 2,93х
Из уравнения (2):
b = 148 ⋅ у / 40 = 3,7у
Составим систему уравнений смесь оксидов:
![]()
![]() 2,93 ⋅ (2,08 – у) + 3,7 у = 6,4
2,93 ⋅ (2,08 – у) + 3,7 у = 6,4
6,09 — 2,93 у + 3,7 у = 6,4
0,77 у = 0,31
у = 0,4 (г).
Следовательно, масса оксида магния (MgO) в смеси оксидов 0,4 грамма.
Используя формулу нахождения массовой доли вещества:
![]()
Рассчитаем массовую долю оксида магния (MgO) в смеси оксидов:
w (MgO) = 0,4 ⋅ 100% / 2,08 = 19,23 (%).
Ответ:
массовая доля оксида магния 19,23%.

Здравствуйте!Спасибо большое. Все стало понятно. У меня возникли проблемы с этой задачкой: либо отрицательные числа в системе, либо массу неправильно нашла.
При обработке смеси карбоната и гидрокарбоната натрия избытком серной кислоты получено 5,68 г. соли и 1,12 дм3 (н. у.) газа. Найдите W (Na2CO3) в смеси. Можно ли эту задачу решить системой?
Рада была помочь!
Да, задачу можно решить системой уравнений. Решение задачи можно посмотреть здесь