Вычислите, какая масса меди необходима для реакции с избытком концентрированной серной кислоты (H2SO4 конц.) для получения 2,1 литра оксида серы (IV) (SO2) (нормальные условия). Практический выход оксида серы (IV) (SO2) реакции 94 %.
Решение задачи
Какая масса меди.
Запишем уравнение реакции взаимодействия концентрированной серной кислоты (H2SO4 конц.) с медью (Cu):
![]()
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
![]()
Вычислим теоретический объем оксида серы (IV) (SO2) по формуле:
![]()
Получаем:
V (теор.) = 2,1 л ⋅ 100% /94% = 2,2 (л).
Какая масса меди. По формуле, устанавливающей связь между химическим количеством вещества и объемом газа, найдем химическое количество оксида серы (IV) (SO2):
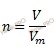
Получаем:
n (SO2) = 2,2 /22,4 = 0,098 (моль).
Из уравнения реакции видно, что в образовании 0,098 моль оксида серы (IV) (SO2) участвует 0,098 моль меди (Cu).
По формуле, устанавливающей связь между массой и химическим количеством вещества, найдем какая масса меди (Cu):
![]()
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль (смотри таблицу Менделеева), найдем какая масса меди:
m (Cu) = 0,098 ⋅ 63,5 = 6,223 (г).
Ответ:
какая масса меди равна 6,223 грамм.

спасибо вам, огромное, вы очень помогли мне.
Пожалуйста!