Смесь меди (Cu) и алюминия (Al) массой 20 грамм обработали соляной кислотой (HCl). При этом выделилось 11,2 дм3 (н.у.) водорода (H2). Определить массовую долю (%) каждого металла в смеси.
Решение задачи
Напомню, что соляная кислота (HCl) обладает слабыми окислительными свойствами, следовательно, соляная кислота (HCl) реагирует с металлами стоящими в электрохимическом ряду напряжений левее (до) водорода (H2).
Таким образом, соляная кислота (HCl) будет реагировать с алюминием (Al) и не будет реагировать с медью (Cu).
Запишем уравнение реакции взаимодействия соляной кислоты (HCl) с алюминием (Al):
![]() Учитывая, что молярная масса алюминия (Al) равна 27 г/моль, вычислим массу алюминия (Al) по формуле, устанавливающей связь между массой и химическим количеством вещества:
Учитывая, что молярная масса алюминия (Al) равна 27 г/моль, вычислим массу алюминия (Al) по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Учитывая количество моль из уравнения реакции получаем:
m (Al) = 2 моль ∙ 27 г/моль = 54 (г)
По уравнению реакции найдем, сколько алюминия (Al) (в г) взаимодействует с соляной кислотой (HCl):
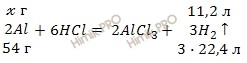
при взаимодействии ![]() г Al с HCl выделяется 11,2 л H2
г Al с HCl выделяется 11,2 л H2
при взаимодействии 54 г Al с HCl выделяется 67,2 л H2
Откуда:
![]()
Найдем массу меди (Cu) по формуле:
m (Cu) = m (смеси) — m (Al)
Получаем:
m (Cu) = 20 г – 9 г = 11 (г).
Найдем массовую долю алюминия (Al) в смеси по формуле:
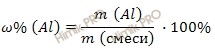
Получаем:
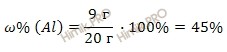
Рассчитаем массовую долю меди (Cu) в смеси по формуле:
ω% (Cu) = 100% — ω% (Al)
Получаем:
ω% (Cu) = 100% — 45% = 55%
Ответ: массовая доля алюминия равна 45%, массовая доля меди равна 55%.
