Равновесные концентрации в системе 2SO2 + O2 = 2SO3, составили [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) (SO2) и кислорода (O2).
Решение задачи
Рассмотрим обратимую химическую реакцию:
![]()
Вычислите константу равновесия. Константа равновесия данной реакции выражается уравнением:
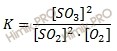
Подставляя в формулу данные из условия задачи, вычислите константу равновесия:
K = (0,02)2 /(0,04)2 ⋅ 0,06 = 0,0004 /0,0016 ⋅ 0,06 = 4,17
Для нахождения исходных концентраций SO2 и О2 учтем, что, согласно уравнению реакции, из 2 моль SO2 и 1 моль О2 образуется 2 моль SO3. Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль вещества SO3, то при этом было израсходовано 0,02 моль SO2 и 0,01 моль О2. Таким образом, искомые исходные концентрации равны:
C(SO2) = 0,04 + 0,02 = 0,06 (моль/л);
C(О2) = 0,06 + 0,01 = 0,07 (моль/л).
Вычислите константу равновесия.
Ответ:
константа равновесия 4,17;
исходная концентрация SO2 0,06 моль/л;
исходная концентрация О2 0,07 моль/л.

Спасибо, ваш сайт с задачами по химии помогает готовиться к поступлению в ВУЗ
Спасибо, мне очень приятно!
Можно узнать, почему именно из 0,2 моль образовалось 0,2 и 0,1 моль? Я не понимаю чего-то.
По уравнению реакции равновесной системы находим, что на образование 0,02 моль/л SO3 (то есть до установления равновесия в системе) было израсходовано 0,02 моль SO2 и 0,01 моль О2.
2SO2 + O2 = 2SO3
Cизр.(SO2) = 0,02 ⋅ 2 /2 = 0,02 (моль/л);
Cизр.(О2) = 0,02 ⋅ 1 /2 = 0,01 (моль/л).