Равновесие реакции 2NO + O2 = 2NO2 установилось при следующих концентрациях реагирующих веществ (моль/л): С (NO) = 0,5; С (O2) = 0,7; С (NO2) = 2,1.
Как изменится скорость прямой и обратной реакций, если в системе уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия реакции?
Решение задачи
Уравнение реакции имеет вид:
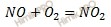
До уменьшения давления в системе выражения для скоростей прямой и обратной реакций будут:
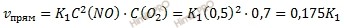
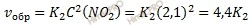
При уменьшении в системе давления в 2 раза концентрация всех реагирующих веществ уменьшается в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда:
𝑣 ,прям = K1 (0,5 /2)2 ⋅ (0,7 /2) = 0,0219 K1
𝑣 ,обр = K2 (2,1 /2)2 = 1,1015 K2
В результате уменьшения давления в системе скорости прямой и обратной реакций уменьшились:
𝑣прям / 𝑣 ,прям = 0,175 K1 /0,0219 K1 = 8
𝑣обр / 𝑣 ,обр= 4,41 K2 /1,1015 K2 = 4.
Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой. Если в системе уменьшить давление, то смещение равновесия произойдет справа налево, то есть в сторону разложения NO2.
Ответ:
скорость обратной реакции будет в 2 раза больше;
смещение равновесия произойдет справа налево.
