Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см3 необходимо взять для приготовления 800 см3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
![]()
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
![]()
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора азотной кислоты (HNO3):
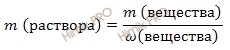
Получаем:
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
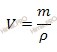
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
