Чему равна нормальность 10-процентного (по массе) раствора йодата калия (KIO3), плотность которого равна 1,052 г/мл, если он восстанавливается до свободного йода?
Решение задачи
II способ решения (I способ)
Данную задачу можно решить, используя формулу перерасчета, которая устанавливает связь между процентной концентрацией и нормальной:

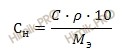
При этом необходимо помнить, что процентная концентрация (C) рассчитывается на определенную массу раствора, а нормальная концентрация рассчитывается на определенный объем раствора, следовательно для перерасчета необходимо знать плотность раствора.
Рассчитаем молярную массу йодата калия (KIO3):
M (KIO3) = 39 + 127 + 3 ∙ 16 = 214 (г/моль).
Рассчитаем молярную массу эквивалента йодата калия (KIO3) по формуле:
![]()
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Учитывая, что по условию задачи йодат калия (KIO3) восстанавливается до свободного йода:
![]()
следовательно, fэкв = 1/5, рассчитаем молярную массу эквивалента йодата калия (KIO3):
MЭ (KIO3) = 214 ∙ 1/5 = 42,8 (г/моль).
Вычислим нормальность 10-процентного раствора йодата калия (KIO3), подставляя все необходимые значения в формулу:
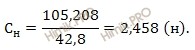
Ответ: нормальность йодата калия = 2,458 моль-экв/л.
