Рассчитайте, какой объем метана (CH4) можно получить из 1 тонны каменного угля, содержащего 85 % по массе углерода (C), если выход реакции получения метана (CH4) составляет 75 %.
Решение задачи
Запишем уравнение реакции получения метана (CH4) из каменного угля:
![]()
Найдем массу углерода (C), вступившего в реакцию. Для этого, используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу вещества:
![]()
Получаем:
m (C) = 1 ∙ 0,85 = 0,85 (т) или 85 ⋅ 104 г.
Если раствор 85-процентный, то массовая доля углерода (C) в нем 0,85.
Учитывая, что молярные массы углерода (C) и метана (CH4) соответственно равны 12 г/моль и 16 г/моль, по уравнению реакции рассчитаем теоретический выход реакции получения метана (CH4):
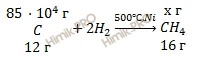
из 12 г углерода (C) получают метана (CH4) 16 г
из 85 ⋅ 104 г углерода (C) получают метана (CH4) х г
Откуда:
![]()
Учитывая, что метан (CH4) – газ, вычислим объем метана (CH4), по формуле перерасчета, устанавливающей связь между массой и объемом газа:
![]()
Получаем:
V (CH4) = 113,3 ⋅ 104 ∙ 22,4 / 16 = 158,62 ⋅ 104 (л).
Найдем практический объем метана (CH4) (практический выход реакции получения метана (CH4)) с учетом выхода по формуле:
![]()
Получаем:
V (практ.) = 158,62 ⋅ 104 л ⋅ 75 % / 100 % = 119 ⋅ 104 (л) или 1190 м3.
Ответ:
объем метана равен 1190 м3.
