При электролизе раствора хлорида меди (II) (CuCl2) на аноде выделилось 560 мл газа (условия нормальные). Найдите массу меди, выделившейся на катоде.
Решение задачи
По условию задачи протекает электролиз раствора хлорида меди (CuCl2). Рассмотрим механизм электролиза раствора хлорида меди (CuCl2), учитывая, что раствор соли хлорида меди (CuCl2), образован малоактивным металлом (Cu) и бескислородным кислотным остатком (Cl—).
Запишем уравнение диссоциации электролита:
![]() Процесс, протекающий на катоде (-) при электролизе раствора хлорида меди (CuCl2):
Процесс, протекающий на катоде (-) при электролизе раствора хлорида меди (CuCl2):
![]() Процесс, протекающий на аноде (+) при электролизе раствора хлорида меди (CuCl2):
Процесс, протекающий на аноде (+) при электролизе раствора хлорида меди (CuCl2):
![]()
![]() Запишем ионно-молекулярное уравнение электролиза раствора хлорида меди (CuCl2):
Запишем ионно-молекулярное уравнение электролиза раствора хлорида меди (CuCl2):
![]()
На основании ионно-молекулярное уравнения составим молекулярное уравнение электролиза раствора хлорида меди (CuCl2):
![]()
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита и сопровождающийся разложением расплавленного или растворенного вещества или воды.
Найдем химическое количество газа (хлора), который выделился на аноде при электролизе. Для этого будем использовать формулу нахождения химического количества вещества через объем:
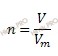
Получаем:
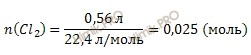
По уравнению реакции электролиза раствора хлорида меди (CuCl2) найдем, сколько меди (Cu) (в молях) выделилось на катоде:

Откуда:
![]()
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль, вычислим массу меди (Cu), выделившейся на катоде, по формуле, устанавливающей связь между массой и количеством вещества:
![]()
Получаем:
m (Cu) = 0,025 моль ∙ 63,5 г/моль = 1,588 (г).
Ответ: масса меди = 1,588 грамм.

Огромное спасибо! Рад, что есть люди, которые занимаются этим не ради денег — на вас держится мир)
Спасибо! Мне действительно нравится помогать тем, кто интересуется химией. Я сама вспоминаю то время, когда нуждалась в помощи, но подобных ресурсов не было
Спасибо! Очень помогло!
Пожалуйста!