Какова массовая доля сульфата натрия (Na2SO4) в растворе, полученном при растворении в 300 граммах воды 1 моль глауберовой соли (Na2SO4 10H2O)?
Решение задачи
При решении данной задачи будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
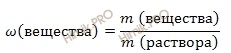
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Найдем массу безводного сульфата натрия (Na2SO4), содержащегося в 1 моль кристаллогидрата (Na2SO4 10H2O).
Для этого рассчитаем молярные массы сульфата натрия (Na2SO4) и глауберовой соли (Na2SO4 10H2O):
M (Na2SO4) = 142 (г/моль),
M (Na2SO4 10H2O) = 142 + 10 18 = 322 (г/моль).
Учитывая, что в 1 моль глауберовой соли (Na2SO4 ∙ 10H2O) содержится 1 моль безводного сульфата натрия (Na2SO4) и что молярные массы глауберовой соли (Na2SO4 10H2O) и безводного сульфата натрия (Na2SO4) соответственно равны 322 и 142 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]() Получаем:
Получаем:
m (Na2SO4) = 142 (г),
m (Na2SO4 10H2O) = 322(г).
Найдем массу раствора, используя формулу нахождения массы раствора:
![]() Следовательно:
Следовательно:
m (раствора) = 322 г + 300 г = 622 (г).
Используя формулу нахождения массовой доли растворенного вещества в растворе, вычислим массовую долю сульфата натрия (Na2SO4) в растворе глауберовой соли (Na2SO4 10H2O):
![]()
Ответ: массовая доля сульфата натрия (Na2SO4) в растворе = 0,23 или 23 %.
