Сколько соли образуется в граммах при взаимодействии 44,8 литров аммиака (NH3) и 33,6 литров хлороводорода (HCl).
Решение задачи
Напомню, вещества вступают в реакцию в определенных стехиометрических отношениях. Если для реакции взяты вещества в отношениях, не соответствующих стехиометрическим, то одно из них окажется в избытке. Масса образовавшегося продукта определяется по массе исходного вещества, прореагировавшего полностью. Такие задачи относят к задачам на избыток-недостаток.
Составим уравнение реакции взаимодействии аммиака (NH3) c хлороводородом (HCl):
![]()
Сколько соли образуется.
Используя формулу перерасчета, найдем массу аммиака (NH3) и хлороводорода (HCl), вступивших в реакцию:
![]()
Рассчитаем молярные массы аммиака (NH3), хлороводорода (HCl) и соли хлорида аммония (NH4Cl) (смотри таблицу Менделеева):
M (NH3) = 14 + 3 ⋅ 1 = 17 (г/моль);
M (HCl) = 1 + 35,5 = 36,5 (г/моль);
M (NH4Cl ) = 14 + 4 ⋅ 1 + 35,5 = 53,5 (г/моль).
Получаем:
m (NH3) = 44,8 ⋅ 17 /22,4 = 34 (г);
m (HCl) = 33,6 ⋅ 36,5 /22,4 = 54,75 (г).
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке. Для удобства расчета за х г примем массу хлороводорода (HCl):
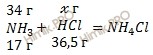
17 г NH3 вступает в реакцию с 36,5 г HCl
34 г NH3 вступает в реакцию с х г HCl
Откуда:
![]()
Следовательно, хлороводород (HCl) дан в недостатке, так как по условию его 54,75 г, а по расчету необходимо 73 г, поэтому расчет ведем по хлороводороду (HCl), найдем сколько грамм образуется:

36,5 г HCl участвует в образовании 53,5 г соли
54,75 г HCl участвует в образовании у г соли
Откуда найдем сколько соли образуется:
![]()
Ответ:
масса соли 80,25 грамм.
