Какую массу можно получить аспирина из 103,5 грамм салициловой кислоты, если выход продукта равен 60 %? Ответ выразите в граммах, округлите до целых.
Решение задачи
Одним из способов получение аспирина (C9H8O4) происходит путём взаимодействия салициловой кислоты (C7H6O3) и уксусного ангидрида реакцией этерификации в присутствии серной кислоты. Для очистки продукт перекристаллизовывают.
Запишем схематично уравнение реакции получения аспирина:
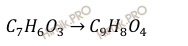
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
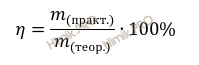
Учитывая, что молярная масса салициловой кислоты (C7H6O3) и аспирина (C9H8O4) соответственно равна 138 г/моль и 180 г/моль (смотри таблицу Менделеева), рассчитаем теоретическую массу аспирина (C9H8O4), который образуется в ходе реакции получения аспирина:
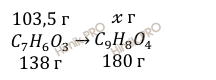
из 103,5 г C7H6O3 образуется х г аспирина (C9H8O4)
из 138 г C7H6O3 образуется 180 г аспирина (C9H8O4)
Откуда:
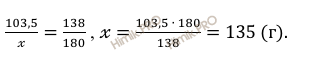
Рассчитаем практическую массу полученного аспирина (C9H8O4) по формуле:
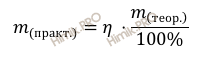
mпракт(C9H8O4)= 60 ⋅ 135 / 100 = 81 (г).
Ответ:
получили аспирин (C9H8O4) массой 81 грамм.
