Оксид натрия (Na2O) массой 12,4 грамма растворили в воде (H2O). Какой объём оксида углерода (IV) (CO2) измеренный при нормальных условиях, потребуется для нейтрализации полученного гидроксида натрия (NaOH), если нужно получить кислую соль?
Решение задачи
Запишем уравнение реакции взаимодействия оксида натрия (Na2O)с водой (H2O):
![]()
Запишем уравнение реакции нейтрализации гидроксида натрия (NaOH) оксидом углерода (IV) (CO2), в результате которой получается кислая соль:
![]()
Рассчитаем молярные массы оксида натрия (Na2O) и гидроксида натрия (NaOH):
M (Na2O) = 2 ∙ 23 + 16 = 62 (г/моль);
M (NaOH) = 23 + 16 + 1 = 40 (г/моль).
По уравнению реакции рассчитаем массу гидроксида натрия (NaOH), полученного при растворении в воде (H2O) оксида натрия (Na2O):
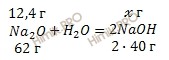
62 г оксида натрия (Na2O) участвует в получении 80 г NaOH
12,4 г оксида натрия (Na2O) участвует в получении х г NaOH
Откуда:
![]()
По уравнению реакции рассчитаем объём оксида углерода (IV) (CO2), который потребуется для нейтрализации полученного гидроксида натрия (NaOH):
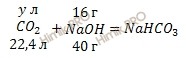
22,4 л CO2 нейтрализует 40 г NaOH
y л CO2 нейтрализует 16 г NaOH
Откуда:
![]()
Следовательно, для нейтрализации гидроксида натрия (NaOH) потребуется 8,96 л оксида углерода (IV) (CO2).
Ответ:
для нейтрализации гидроксида натрия потребуется 8,96 литра оксида углерода (IV).

СПАСИБО БОЛЬШОЕ!!!
Рада была помочь!