Какая масса сульфита натрия (Na2SO3) потребуется для восстановления 0,05 литра 0,1 нормального перманганата калия (KMnO4) в присутствии серной кислоты?
Решение задачи
Реакция взаимодействия между сульфитом натрия (Na2SO3) и перманганатом калия (KMnO4) протекает по уравнению:
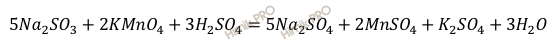
Молярная масса перманганата калия (KMnO4) равна 158 г/моль (смотри таблицу Менделеева).
В этой реакции перманганат калия (KMnO4), являясь окислителем, принимает 5е—, следовательно, молярная масса эквивалента перманганата калия (KMnO4) равна:
Mэкв (KMnO4) = 158 /5 =31,6 (г/моль).
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N»
Соответственно, масса перманганата калия (KMnO4), содержащегося в 0,05 л 0,1 н раствора равна:
3,16 ⋅ 0,05 = 0,158 г.
По формуле, устанавливающей связь между массой и химическим количеством вещества:
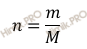
найдем, какое количество перманганата калия (KMnO4) участвует в реакции:
n (KMnO4) = 0,158 /158 = 0,001 (моль).
Найдем, какое количество сульфита натрия (Na2SO3) участвует в реакции:
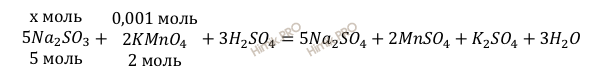
5 моль Na2SO3 взаимодействует с 2 моль KMnO4
х моль Na2SO3 взаимодействует с 0,001 моль KMnO4
Откуда:
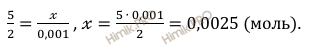
Молярная масса сульфита натрия (Na2SO3) равна 126 г/моль (смотри таблицу Менделеева).
Найдем массу сульфита натрия (Na2SO3), которая потребуется для восстановления 0,05 литра 0,1 нормального перманганата калия (KMnO4) в присутствии серной кислоты по формуле:
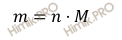
Получаем, что масса сульфита натрия равна:
m (Na2SO3) = 0,0025 ⋅ 126 = 0,315 (г).
Ответ:
масса сульфита натрия равна 0,315 г.
