К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
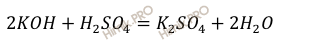
Используя формулу нахождения массовой доли растворенного вещества:
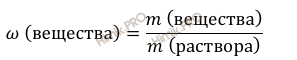
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m (вещества KOH) = 25 ∙ 0,98 = 24,5 (г).
Если раствор 98-процентный (известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на нейтрализацию 112 г KOH нужно 98 г H2SO4
на нейтрализацию 24,5 г KOH нужно х г H2SO4
Откуда:

Это означает, что серная кислота (H2SO4) находится в избытке и дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
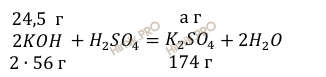
112 г KOH нужно для образования 174 г соли
24,5 г KOH нужно для образования а г соли
Откуда масса образовавшейся соли:
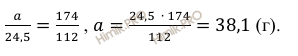
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна 38,1 грамм.
