Cколько граммов серной кислоты (H2SO4) можно получить, если в реакцию вступило 20 литров серного газа (SO3) и 20 грамм воды (H2O)? Определить воды избыток недостаток.
Решение задачи
Запишем уравнение реакции получения серной кислоты (H2SO4):
![]()
Найдем массу серного газа (SO3) по формуле:
![]()
Получаем:
m (SO3) = 80 ⋅ 20 /22,4 = 71,4 (г).
Рассчитаем молярные массы интересующих нас веществ: серного газа (SO3), воды (H2O), серной кислоты (H2SO4).
M (SO3) = 32 + 3 ⋅ 16 = 80 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль);
M (H2SO4) = 2 ⋅ 1 + 32 + 4 ⋅ 16 = 98 (г/моль).
Для удобства расчета за х примем массу воды (H2O) и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке. Определить воды избыток недостаток.
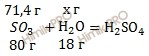
80 г серного газа (SO3) вступает в реакцию с 18 г воды (H2O)
71,4 г серного газа (SO3) вступает в реакцию с х г воды (H2O)
Откуда:
![]()
Следовательно, вода (H2O) дана в избытке, так как по условию ее 20 г, а по расчету необходимо 16,01 г, поэтому расчет ведем по серному газу (SO3):
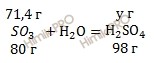
80 г серного газа (SO3) участвует в реакции образования 98 г серной кислоты (H2SO4)
71,4 г серного газа (SO3) участвует в реакции образования х г серной кислоты (H2SO4)
Откуда:
![]()
Ответ:
масса серной кислоты равна 87,5 грамма.
