Вычислить массу ацетата натрия метан (CH3COONa), потраченную для получения 120 грамм метана (CH4), если выход продукта реакции составляет 75 %.
Решение задачи
Запишем уравнение реакции получения метана (CH4) лабораторным способом путем сплавления ацетата натрия метан (CH3COONa) с твердой щелочью (NaOH):
![]()
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
По условию задачи практическая масса составляет 120 г метана (CH4). Рассчитаем теоретическую массу ацетата натрия метан по вышеуказанной формуле:
m теор. (CH4) = 120 ⋅ 100 / 75 = 160 (г).
Рассчитаем молярную массу метана (CH4) и ацетата натрия (CH3COONa), используя значения таблицы Менделеева, ацетат натрия метан:
M (CH4) = 12 + 4 ⋅ 1 = 16 (г/моль),
M (CH3COONa) = 12 + 3 ⋅ 1 + 12 + 16 + 16 + 23 = 82 (г/моль).
Вычислим массу ацетата натрия метан (CH3COONa) по уравнению реакции:
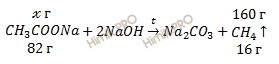
из 82 г ацетата натрия (CH3COONa) получают 16 г метана (CH4)
из х г ацетата натрия (CH3COONa) получают 160 г метана (CH4)
Откуда:
![]()
Ответ:
масса ацетата натрия равна 820 грамм.


здравствуйте Ольга. некоторие специалисти решают эту задачку по другим способом. например.
82*90/16=461,25 из уровнение 120*75/100=90 и 82*90/16=461.25 в некоторых книгах данны эти ответы. который из ных правилнее. заранеее спосибо .
Здравствуйте! Обратите внимание на то, что в условии задачи дана практическая масса, в уравнении реакции теоретическая масса. Задача решена верно.