Константа диссоциации азотистой кислоты (HNO2) составляет 5 ∙ 10-4. Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H+]) для 0,05 раствора этой кислоты.
Решение задачи
II способ решения (I способ)
Запишем уравнение диссоциации азотистой кислоты:
![]()
Напишем выражение для константы диссоциации азотистой кислоты в общем виде:
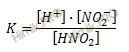
Внесу немного пояснений. Числитель представляет собой произведение концентраций ионов. Так как, эти концентрации равны друг другу, поэтому числитель можно заменить выражением [H+]2. Знаменатель представляет собой концентрацию недиссоциированной части кислоты, которую, если пренебречь диссоциированной частью, примем равной общей концентрации электролита. В итоге получаем:
![]()
откуда:
![]()
Хочу обратить ваше внимание на то, что данная формула может быть использована для вычисления степени диссоциации (α) и равновесной концентрации ионов водорода [H+] лишь при условии, что концентрация слабого электролита в 100 или более раз больше его константы диссоциации. В решенной задаче отношение C / K = 100.
Найдем равновесную концентрацию ионов водорода:
![]()
Вычислим степень диссоциации азотистой кислоты по формуле:
![]()
![]()
Ответ: степень диссоциации азотистой кислоты = 10 %; равновесная концентрация ионов водорода = 0,005 моль/л.

Спасибо! Очень интересно.К тому же во многих олимпиадах по химии в том числе и Менделеевских очень много задач на эту тему. Но стоит добавить, что для смесей нужна формула [H+]=кореннь из(c0(K1+K2+K3….)
Спасибо, Максим! Думаю, что формула поможет кому-нибудь в решении похожей задачи