Константа диссоциации азотистой кислоты (HNO2) составляет 5 ∙ 10-4. Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H+]) для 0,05 раствора этой кислоты.
Решение задачи
I способ решения (II способ)
Запишем уравнение диссоциации азотистой кислоты:
![]()
Данную задачу я предлагаю решать через закон разбавления Оствальда в его приближенном варианте, используя формулу:
![]()
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Хочу обратить ваше внимание на то, что данная формула может быть использована для вычисления степени диссоциации (α ) и равновесной концентрации ионов водорода [H+] лишь при условии, что концентрация слабого электролита в 100 или более раз больше его константы диссоциации (K). В решенной задаче отношение C / K = 100.
Константа диссоциации характеризует способность электролита диссоциировать на ионы.
Найдем степень диссоциации азотистой кислоты, подставив известные значения из условия задачи в формулу:
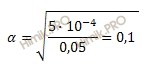
что соответствует 10 %.
Найдем равновесную концентрацию ионов водорода:
![]() Получаем:
Получаем:
Ответ: степень диссоциации азотистой кислоты = 10 %; равновесная концентрация ионов водорода = 0,005 моль/л.
