Рассчитать pH 0,1 молярного раствора гидроксида натрия (NaOH).
Решение задачи
Запишем уравнение диссоциации раствора гидроксида натрия (NaOH):
![]()
Учитывая, что раствор гидроксида натрия (NaOH) 0,1 M по уравнению диссоциации вычислим, сколько моль гидроксид-ионов (OH—) образуется при полной диссоциации 0,1 моль раствора гидроксида натрия (NaOH):
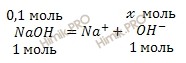
Напомню, молярная концентрация – число молей вещества содержащегося в единице объема раствора.
Составим пропорцию:
при диссоциации 1 моль NaOH образуется 1 моль ионов OH—
при диссоциации 0,1 моль NaOH образуется ![]() моль ионов OH—
моль ионов OH—
Откуда:
![]()
Следовательно, концентрация гидроксид-ионов (OH—) равна:
[OH—] = 0,1 = 10-1 (моль/л).Зная концентрацию гидроксид-ионов (OH—), ионное произведение воды дает возможность вычислить концентрацию ионов водорода (H+) в растворе:
K(H2O) = [H+] ∙ [OH—] = 10-14
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды и обозначается K(H2O).
Получаем:
[H+] = 10-14/[OH—] = 10-14/10-1 = 10-13Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Вычислим pH раствора по формуле:
![]()
Получаем:
![]()
Ответ:
pH раствора гидроксида натрия равно 13.

Ольга спасибо Вы очень помогли
Всегда рада помочь
Спасибо большое 🙂
Рада помочь
Большое спасибо! Очень помогает сайт!
Спасибо, я стараюсь 🙂
Спасибо большое:)
Рада помочь