Сколько литров аммиака (NH3) образуется при взаимодействии 112 килограмм азота (N2) с водородом (H2)? Выход от теоретически возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
![]()
Напомню, что под выходом от теоретически возможного продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Выход от теоретически возможного. Учитывая, что молярная масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое количество азота (N2) по формуле, устанавливающей связь между химическим количеством вещества и массой:
![]()
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3) (теоретическое химическое количество вещества), которое выделяется в ходе реакции образования аммиака (NH3):
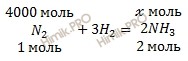
из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
![]()
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем аммиака (NH3), который образуется в ходе реакции:
![]()
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от теоретически возможного) по формуле:
![]()
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36 (м3).
Ответ:
объем аммиака (NH3) равен 143,36 м3.
