При состоянии химического равновесия в системе: N2 + 3H2 ⇄ 2NH3 концентрации веществ составляют: С(N2) = 2 моль/л; С(H2) = 4 моль/л; С(NH3) = 9 моль/л. Найти исходные концентрации азота и водорода.
Решение задачи
Запишем уравнение реакции синтеза аммиака (NH3):
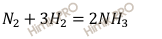
Исходные концентрации азота (N2) и водорода (H2) находим на основе уравнения реакции. На образование 2 моль аммиака (NH3) расходуется 1 моль азота (N2), а на образование 9 моль аммиака (NH3) потребовалось 9 /2 = 4,5 моль азота (N2).
Учитывая равновесную концентрацию азота (N2), находим исходную концентрацию азота:
С (N2) = 2 + 4,5 = 6,5 (моль/л).
На образование 2 моль аммиака (NH3) необходимо израсходовать 3 моль водорода (H2), а для получения 9 моль аммиака (NH3) требуется 3 ⋅ 9 /2 = 13,5 моль.
Учитывая равновесную концентрацию водорода (H2), находим его первоначальную концентрацию:
С (H2) = 4 + 13,5 = 17,5 (моль/л).
Таким образом, реакция начиналась при концентрациях : С (N2) = 6,5 (моль/л), С (H2) = 17,5 (моль/л).
Ответ:
исходная концентрация азота (N2) равна 6,5 моль/л;
исходная концентрация водорода (H2) равна 17,5 моль/л.
