Чему равны pH и pOH 0,01 M раствора соляной кислоты (HCl)?
Решение задачи
Запишем уравнение диссоциации соляной кислоты:
![]()
Учитывая, что раствор соляной кислоты 0,01 M по уравнению диссоциации вычислим, сколько моль ионов водорода H+ образуется при полной диссоциации 0,01 моль соляной кислоты (HCl):
Напомню, молярная концентрация – число молей вещества содержащегося в единице объема раствора.
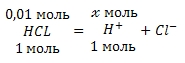
при диссоциации 1 моль HCl образуется ионов H+
при диссоциации 0,1 моль HCl образуется ![]() ионов H+
ионов H+
Откуда:
![]()
Следовательно, концентрация ионов водорода равна:
![]()
Вычислим pH раствора по формуле:
![]()
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
получаем:
![]()
Зная концентрацию ионов водорода, ионное произведение воды дает возможность вычислить концентрацию гидроксид ионов (pOH) в растворе:
![]()
Ответ: pH = 2; pOH = 12.
