Вычислите массовые доли кристаллизационной воды и нитрата меди в тригидрат нитрата меди (II) (Cu (NO3)2 ∙ 3H2O).
Решение задачи
Для нахождения массовых долей сухого вещества и кристаллизационной воды в кристаллогидрате используют следующие формулы:
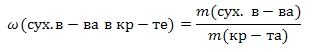
![]()
Рассчитаем молярные массы нитрата меди (II) (Cu (NO3)2), воды (H2O) и кристаллогидрата (Cu (NO3)2 ∙ 3H2O):
M (Cu (NO3)2) = 187,5 (г/моль)
M (H2O) = 18 (г/моль)
M (Cu (NO3)2 ∙ 3H2O) = 187,5 + 3 ∙ 18 = 241,5 (г/моль).
Учитывая, что в 1 моль кристаллогидрата (Cu (NO3)2 ∙ 3H2O) содержится 1 моль нитрата меди (II) (Cu (NO3)2) и 3 моль воды (H2O) найдем массы данных веществ по формуле:
![]() Получаем:
Получаем:
m (Cu (NO3)2) = 1 моль ∙ 187,5 г/моль = 187,5 (г)
m (H2O) = 3 моль ∙ 18 г/моль = 54 (г)
m (Cu (NO3)2 ∙ 3H2O) = 1 моль ∙ 241,5 г/моль = 241,5 (г).
Найдем массовые доли нитрата меди (II) и воды:
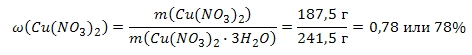
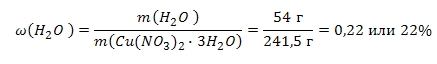
Так как массовая доля кристаллогидрата равна 100%, то массовую долю кристаллизационной воды можно найти следующим образом:
![]()
Ответ: массовая доля кристаллизационной воды = 0,22 или 22%;
массовая доля нитрата меди (II) = 0,78, 78%.
