Сколько граммов соли и воды содержится в 0,3 литрах 10% раствора карбоната натрия (Na2CO3) (ρ = 1,150 г/мл)?
Решение задачи
Учитывая молярную массу карбоната натрия (Na2CO3), смотри таблицу Менделеева:
M (Na2CO3) = 2 ∙ 23 + 12 + 3 ∙ 16= 106 (г/моль)
Определим массу раствора карбоната натрия (Na2CO3) по формуле, устанавливающей связь между массой и объемом раствора:
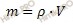
m = 1,15 г/мл ∙ 30 мл = 34,5 (г).
Найдем, какая масса карбоната натрия (Na2CO3) (в г) содержится в растворе. Для расчета будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
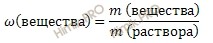
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Откуда выразим m (вещества):
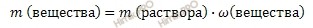
Получаем, что массу карбоната натрия (Na2CO3) равна:
m (Na2CO3) = 34,5 ∙ 0,1 = 3,45 (г).
Если раствор 10-процентный, то массовая доля карбоната натрия (Na2CO3) в нем 0,1.
Найдём массу воды в растворе по формуле:
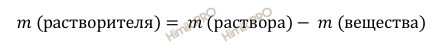
Откуда:
m (H2O) = 34,5 – 3,45 = 31,05 (г).
Ответ:
масса карбоната натрия равна 3,45 грамм;
масса воды равна 31,05 грамм.
