50 грамм мрамора, содержащего 96 процентов карбоната кальция (CaCO3), обработали избытком соляной кислоты (HCl). Какова масса получившейся соли и какой объем газа (н.у) при этом выделится?
Решение задачи
Напомню, что основу химического состава мрамора составляет кальцит – одна из природных форм карбоната кальция (CaCO3).

Запишем уравнение реакции действия соляной кислоты (HCl) на мрамор:
![]() Учитывая, что в состав мрамора входит 96% карбоната кальция (CaCO3), вычислим, сколько карбоната кальция (CaCO3) (в г) содержится в 50 г мрамора по формуле нахождения массы вещества через массовую долю:
Учитывая, что в состав мрамора входит 96% карбоната кальция (CaCO3), вычислим, сколько карбоната кальция (CaCO3) (в г) содержится в 50 г мрамора по формуле нахождения массы вещества через массовую долю:
![]()
Получаем:
m (CaCO3) = 50 г ∙ 0,96 = 48 (г).
Если горная порода 96-процентная, то массовая доля карбоната кальция (CaCO3) в нем 0,96.
Учитывая, что молярная масса карбоната кальция (CaCO3) равна 100 г/моль, найдем химическое количество карбоната кальция (CaCO3)по формуле, устанавливающей связь между химическим количеством вещества и массой:
![]()
Получаем:
n (CaCO3) = 48 /100 = 0,48 (моль).
По уравнению реакции найдем химическое количество полученной соли – хлорида кальция (CaCl2) и химическое количество углекислого газа (CO2), который выделяется в ходе реакции:
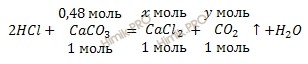
из 1 моль CaCO3 образуется 1 моль CaCl2
из 0,48 моль CaCO3 образуется ![]() моль CaCl2
моль CaCl2
Откуда:
![]()
1 моль CaCO3 участвует в образовании 1 моль CO2
0,48 моль CaCO3 участвует в образовании y моль CO2
Откуда:
![]()
Учитывая, что молярная масса хлорида кальция (CaCl2), рассчитаем массу хлорида кальция (CaCl2) по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (CaCl2) = 0,48 моль ∙ 111 г/моль = 53,28 (г).
По формуле, устанавливающей связь между химическим количеством вещества и объемом, рассчитаем объем углекислого газа (CO2), который образуется в ходе реакции:
![]()
Получаем:
V (CO2) = 0,48 ∙ 22,4 = 10,75 (л).
Ответ:
масса соли равна 53,28 грамм, объем углекислого газа 10,75 литра.
