При взаимодействии 110 грамм бензола (C6H6) с хлором (Cl2) получен хлорбензол (C6H5Cl). Какая практическая масса хлорбензола (C6H5Cl), который образовался, когда выход продукта реакции 70 %.
Решение задачи
Запишем уравнение реакции получения хлорбензола (C6H5Cl):
![]()
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
![]()
Учитывая, что молярная масса бензола (C6H6) и хлорбензола (C6H5Cl) соответственно равна 78 г/моль и 112,5 г/моль (смотри таблицу Менделеева), по уравнению реакции найдем массу хлорбензола (C6H5Cl) (теоретическая масса), которая выделяется в ходе реакции получения хлорбензола (C6H5Cl):
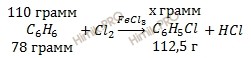
из 78 г C6H6 получается 112,5 г C6H5Cl
из 110 г C6H6 получается х г C6H5Cl
Откуда:
![]()
Вычислим практическую массу хлорбензола (C6H5Cl) по формуле:
![]()
Получаем, что практическая масса:
m практ. (C6H5Cl) = 70 ⋅ 158,7 / 100 = 111,09 (г).
Ответ:
практическая масса хлорбензола равна 111,09 грамм.
